Buchstabe D
Destillation bis Desinfektion von Trinkwasser
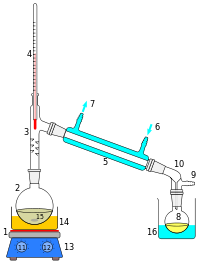
Destillation ist ein thermisches Trennverfahren, um Wasser von schwer verdampfbaren Stoffen abzutrennen. Die Destillation hat gegenüber anderen Trennverfahren den Vorteil, dass in der Regel keine weiteren Stoffe wie Adsorbentien oder Lösungsmittel hinzugefügt werden. Bei der Destillation wird Wasser zunächst zum Sieden gebracht. Der entstehende Dampf wird in einem Kondensator durch Abkühlen wieder verflüssigt. Im Labormaßstab wird oft der Liebigkühler verwendet. Im Anschluss wird das flüssige Kondensat aufgefangen. Typische Anwendungen der Destillation sind das Brennen von Alkohol und das Destillieren (die Rektifikation) von Erdöl in der Raffinerie oder auch die Herstellung von destilliertem Wasser. Destilliertes Wasser das durch Dampfdestillierung gereinigt wurde enthält normalerweise weniger als 5 ppm TDS. (Abb. rechts: Destillation im Labormaßstab)
Dissoziation von Wasser: Unter Dissoziation versteht man einen angeregten oder selbsttätig ablaufenden Vorgang der Teilung einer chemischen Verbindung in zwei oder mehrere Moleküle, Atome oder Ionen. Ein Spezialfall der Dissoziation ist das Gleichgewicht von reinem, unter Luftabschluss destilliertem Wasser. Wasser dissoziiert zu einem ganz geringen Anteil in Hydroxid- und Oxoniumionen (veralteter Begriff: Hydroniumionen). Bei dieser Dissoziationsreaktion wirkt ein Teil des Wassers als Säure und der andere als Base:
H2O + H2O ↔ H3O+ + OH-
Die Leitfähigkeit von destilliertem Wasser wurde im Jahr 1894 zu 0,06·10−6 Ohm−1 bestimmt. Aus der Leitfähigkeit und der Kenntnis der Grenzleitfähigkeiten für Hydronium- und Hydroxidionen lässt sich das Ionenprodukt des Wassers berechnen: Die Gleichgewichtskonstante hat einen Wert von KW = 10−14 mol2/L2 oder pKW = 14.
Dehydration: Abnahme des Körperwassers durch gesteigerte gastrointestinale u.a. Wasserabgabe ohne entsprechende Zufuhr und gleichzeitig auftretende Natriumverluste beeinflussen, je nach ihrer Größe im Verhältnis zum Wasserverlust, die osmolare Konzentration (Menge der gelösten Teilen pro Liter Lösung in mol) des Extrazellulärraums (Raum, der die außerhalb der Zelle befindliche Flüssigkeit enthält).
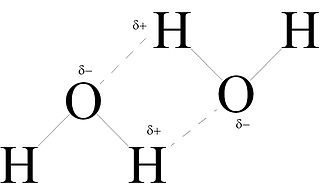
Wasserstoff-Brückenbindungen des Dipols Wasser.
Dipol-Charakter des Wassers:
Wasser ist ein Dipol, das heißt, dass die Wassermoleküle
eine positiv und eine negativ geladene Seite haben. Deshalb lassen
sich Ionen und stark polare Stoffe besser in Wasser lösen, als schwachpolare
Stoffe. Die durch die Ausrichtung permanenter elektrischer Dipole
(z. B. Wasser) in einem elektrischen Feld bewirkte Polarisation
wird Orientierungspolarisation genannt. Die physikalischen, chemischen,
optischen und elektrischen Eigenschaften des Wassers beruhen neben
dem Aufbau des Wassermoleküls auch auf den daraus resultierenden
Verkettungen und Wechselwirkungen der Wassermoleküle untereinander,
die über Wasserstoffbrückenbindungen, elektrische Dipolkräfte und
weitere Kräfte wie Van-der-Waals-Kräfte zustande kommen. Alle sich
durch den Aufbau des Wassermoleküls bedingten Besonderheiten,führen
zu dessen Neigung über Wasserstoffbrückenbindungen vernetzte Cluster
(siehe Bild rechts) zu bilden. Diese zusätzlichen Bindungen, die
bei den anderen Stoffen nicht vorkommen, müssen bei jedem Phasenübergang
der Aggregatzustände zusätzlich überwunden bzw. berücksichtigt werden.
 Durch
den Dipol Charakter des Wassers (Plus-Minus Ladung im Wassermolekül),
entstehen ↗ Wasserstoffbrücken. Diese
Bindungen zwischen bis zu einigen Tausend Wassermolekülen, können
sich z.B. im Gehirn zu hochgradig kristallinen Strukturen ausbilden:
Das Gehirnwassser besteht zu 90% aus Wasser und "gefriert"
bei ca. 37° indem es gelartig wird. Die kristallinen Gitternetze
der Wassercluster schwingen dabei in hohen Frequenzen, die von der
Bewegung der einzelnen Moleküle abhängen.
Durch
den Dipol Charakter des Wassers (Plus-Minus Ladung im Wassermolekül),
entstehen ↗ Wasserstoffbrücken. Diese
Bindungen zwischen bis zu einigen Tausend Wassermolekülen, können
sich z.B. im Gehirn zu hochgradig kristallinen Strukturen ausbilden:
Das Gehirnwassser besteht zu 90% aus Wasser und "gefriert"
bei ca. 37° indem es gelartig wird. Die kristallinen Gitternetze
der Wassercluster schwingen dabei in hohen Frequenzen, die von der
Bewegung der einzelnen Moleküle abhängen.
Insofwern hat jedes Wasser sein individuelles eigenes identifizierbares
Frequenz- und Schwingungsspektrum, das als Relief abbildbar ist.
In ↗ Clustern werden auch Informationen
anderer Stoffe gespeichert, indem sie anfangs von den H2O-Molekülen
der Cluster umhüllt werden. Dadurch verändert sich die Geometrie
der Cluster und es entstehen neue Muster. Diese Muster bzw. Frequenz-Signale
kann Wasser speichern oder an andere Wässer oder an Lebewesen weitergeben.
Desinfektion:
Abtöten von Erregern übertragbarer Krankheiten; ist bei
Trinkwasser dann zwingend notwendig, wenn Coli-Bakterien, Fäkalstreptokokken
oder hohe Koloniezahlen auftreten. Als Desinfektionsmittel stehen
u. a. Chlordioxid, Chlorgas, Natriumhypochlorit oder Ozon zur Verfügung.
Neben Chlorung ist unter bestimmten Voraussetzungen auch UV-Bestrahlung
möglich. Die UV-Desinfektion ist aus vielen Bereichen nicht mehr
wegzudenken. Sie kommt überwiegend dann zum Einsatz, wenn hohe mikrobiologische
Anforderungen an das Permeat, Prozess- oder Trinkwasser gestellt
werden oder chemische Desinfektionsmittel aus Qualitäts- oder Umweltschutzgründen
nicht angewendet werden. Immer häufiger ist der Einsatz der UV-Desinfektion
also die beste Variante, wenn ein sicheres, umweltfreundliches Desinfektionsverfahren
benötigt wird. Eines der Hauptargumente gegen die Regenwassernutzung
ist das Auftreten mikrobiologischer Verunreinigungen. Die UV-Desinfektion
schafft hier problemlos Abhilfe.
Desinfektion von Trinkwasser
In der Trinkwasserverordnung wird gefordert:
- Zahl der coliformen Keime, Escherichia coli u. Enterokokken 0/100
ml,
- Grenzwert für Koloniezahl 100/ml am Zapfhahn
- keine anormale Veränderung (als Indikatorparameter)
- Koloniezahl 20/ml unmittelbar nach Abschluss der Aufbereitung
im desinfizierten Wasser
- Nachweis des freien Chlor min. 0,1 mg/l, wenn Desinfektion auf
Chlorbasis
- bzw. min. 0,05 mg/l an Chlordioxid jeweils nach Abschluss der
Aufbereitung.
Die mikrobiologische
Als Verfahren sind für Trinkwasser gebräuchlich:
- Erhitzen, Feinfiltern, Oxidationsmittel, UV-Bestrahlungen und
Metallionen-Zugabe.
- Von den Oxidationsmitteln werden überwiegend die Halogene Chlor
u. Chlordioxid, selten Brom und Jod verwendet. Chlor am häufigsten,
Brom gelegentlich für Badewasseraufbereitung, Jod für kleine Anlagen.
- Ozon wird wegen der höheren Kosten im allgemeinen mehr als hochwirksames
Oxidationsmittel angewendet.
- Wasserstoffsuperoxid ist zwar ein starkes Oxidationsmittel, hat
aber nur geringe Desinfektionswirkung u. ist deshalb zur Desinfektion
nicht zugelassen.
- Bei der Desinfektion mit Metallionen ist nur das Silberungsverfahren
unter bestimmten Voraussetzungen verwendbar.
- Kupferionen haben zwar eine gute Wirkung zum Abtöten von Algen,
eine geringe dagegen bei der Desinfektion.
- Auch eine Verzinkung eines Stahlrohres (Hausanschlussleitungen)
bewirkt ein langsames Abtöten der Keime, ohne dass es als Desinfektionsverfahren
verwendbar ist.
Beschaffenheit des Trinkwassers muss laufend überwacht werden!
Chlorung
Chlorungsverfahren - In der Praxis werden
im wesentlichen verwendet:
- Chlorgas,
- Chlordioxid,
- Natriumhypochlorit, flüssig als Chlorbleichlauge bezeichnet,
- Calciumhypochlorit, fest in Tablettenform.
Gehalt an wirksamen Chlor der gebräuchlichen Chlorverbindungen
| Bezeichnung | Gehalt an wirksamem Chlor (%) |
| Chlor | 100 |
| Chlorkalk | 33-37 |
| Natriumhypochlorit | 15-16 |
| Calciumhypochlorit | 75 |
Die Chlorung ist für die zentrale Wasserversorgung noch immer das gebräuchlichste Desinfektionsverfahren, da sowohl die Kosten der erforderlichen Apparate als auch die laufenden Betriebskosten gering sind, die Wirkung der Desinfektion durch den einfach zu führenden Nachweis des Chlorgehalts, teilweise sogar nur über die Redox-Spannung, geprüft werden kann und eine bei ordnungsgemäßer Durchführung gegebene Depotwirkung Wiederverkeimungen im Verteilungsnetz verhindert.
Nicht mehr zugelassen ist die Chlorung zur Oxidation anorganischer und organischer Wasserinhaltsstoffe, ebenso sollte die Zugabe hoher Chlormengen bei der Desinfektion nach Möglichkeit unterbleiben, da die Gefahr der Bildung von krebserregenden Trihalogenmethanen besteht (Grenzwert 0,025 mg/l).
Die zulässige Zugabe ist deshalb durch die Trinkwasserverordnung für Chlor, Natrium-, Calcium- und Magnesiumhypochlorit sowie Chlorkalk auf 1,2 mg/l an freiem Chlor begrenzt worden, nur in Ausnahmefällen bei sonst gegebener hygienischer Gefährdung sind bis 6 mg/l gestattet.
Im abgegebenen Reinwasser dürfen nach der Aufbereitung nur noch maximal 0,3 mg/l an freiem Chlor bzw. in Ausnahmefällen bis 0,6 mg/l nachweisbar sein. Einige Wasserwerke haben deshalb auf Chlordioxid, bei dessen Zugabe solche Haloforme nicht entstehen, oder andere Desinfektionsverfahren umgestellt.
Eine sichere Desinfektion wird erreicht, wenn
1. eine gründliche Durchmischung des Desinfektionsmittels
mit dem Wasser erfolgt.
2. eine ausreichend lange Einwirkungszeit des Desinfektionsmittels
vorhanden ist.
3. ein Chlorgehalt von 0,1 mg/1 an freiem Chlor dauernd nachgewiesen
wird, bei Chlordioxid 0,05 mg/1 an Cl02 .
Chlorgas (DIN 19606
und 19607): Eigenschaften – Cl2 ist ein gelb-grünliches
Gas, das sehr giftig ist. In Tab. ist die Wirkung von Chlorgas bei
verschiedenen Konzentrationen in 1 m3 Luft auf den Menschen
angegeben. Chlorgas ist etwa 2,5 mal schwerer als Luft.
| Bezeichnung | ml Chlorgas in m3 Luft |
| zulässiger Chlorgehalt in Luft. während 8 Arbeitsstunden | 0,5 - 1,58 mg/l |
| merkbarer Geruch | |
| Reizungen im Hals, | |
| Husten, | |
| Maximalwert für einen kurzen Aufenthalt | |
| Gefährlich, bereits bei kurzem Aufenthalt | |
| Schnell tödlich |
Chlordioxid ClO2
- Orangefarbenes Gas, 2,5mal höhere Oxidationskraft
als Chlor
- Vorteil: es entstehen keine Nebenprodukte wie Chlophenol, es reagiert
nicht mit Ammonium, keine cancerogenen Stoffe
- Chlordioxid ist explosiv, keine Anlieferung in Behältnissen,
- wird am Gebrauchsort hergestellt aus Natriumchlorit und Chlor
oder Natriumchlorit und Salzsäure
- Lösung von Cl2 im Wasser und als 8 %ige Lösung dem
aufbereitetem Wasser zugegeben
- Natriumchlorit darf nicht in das Wasser gelangen
- Chlordioxidverfahren wird bei größeren WVU zunehmend eingesetzt
wegen besserer Handhabung der Grundstoffe und weil keine unerwünschten
Nebenprodukte entstehen (Haloforme) bei Wässern mit organischer
Belastung (OW, UF, belastetes GW)
Natriumhypochlorit
- ätzende und stark giftige Lösung (Lauge)
- Einfache Handhabung, wird in Behältern angeliefert
- Zugabe über einfache Dosierpumpen möglich
- Einsatz zur Desinfektion von Anlagenteilen, bei kleinen WW
- Nachteile: geringe Haltbarkeit, höhere Kosten, Zersetzung durch
Licht, Temperatur, Verunreinigungen, bei Spuren von Eisen und Metallen
ebenfalls rasche Zersetzung
UV-Bestrahlung:
Wellenlänge 200 bis 300 nm, Wirkungsmaximum bei 260
nm
Antibakterielle Wirkung, da die Strahlung die das Genmaterial enthaltenden
Nukleinsäuren verändert. Diese führen zum Verlust der Vermehrungsfähigkeit
und zum Zelltod.
Zur Inaktivierung der Bakterien muss Strahlung diese erreichen,
d.h. das Wasser muss frei sein von trübenden und färbenden Stoffen,
es muss dicht am Strahler vorbeifließen und es muss ausreichende
Strahlungsdosis vorhanden sein, mind. 25 mJ/cm 2
Hoher Wartungsaufwand (Reinigung und Wechslung der Strahler).
Einsatz von Hg-Dampflampen mit 254 nm.
Um die Wirksamkeit der UV-Desinfektion nachzuweisen, muss eine biodosimetrische
Prüfung der Anlage gemäß DVGW-Arbeitsblatt W 294 erfolgen.
Voraussetzung für die Gewährleistung einer sicheren Desinfektion
ist der Einsatz einer für das jeweilige Wasser und den erforderlichen
Durchsatz ausgelegten UV-Bestrahlungsanlage.
Die überwachung erfolgt über die kontinuierliche Erfassung des Sensormesswertes.
Grundsätzlich müssen für die Trinkwasseraufbereitung zertifizierte
UV-Anlagen eingesetzt werden. ↗ Ultraviolettstrahlung
(UV-Strahlung)
Ozonierung
Im Hinblick auf den Einsatz der Ozonierung ist festzustellen,
dass diese zu einer erhöhten Bildung biologisch abbaubarer Stoffe
führt und deshalb nicht als letzte Aufbereitungsstufe eingesetzt
werden kann. In der Regel ist die Nachschaltung einer biologisch
arbeitenden Filterstufe erforderlich. Einschränkungen für den Ozoneinsatz
können sich durch die Bildung von Bromat ergeben, wenn das zu desinfizierende
Wasser erhöhte Bromidgehalte aufweist.
Entscheidender Vorteil der UV-Bestrahlung im Vergleich zum Einsatz
chemischer Desinfektionsmittel ist, dass es sich hier um ein praktisch
nebenproduktfreies Desinfektionsverfahren handelt. Voraussetzung
für die Anwendung ist, dass das desinfizierte Wasser biologisch
stabil ist, da nach Abschluss der Desinfektion keine Restdesinfektionskapazität
mehr aufrecht erhalten werden kann. Die UV-Bestrahlungsanlage muss
für die jeweilige Wasserbeschaffenheit ausgelegt werden.
Off-Topic
Animierter DNA-Doppelhelix-Ausschnitt
DNS: Die Desoxyribonukleinsäure
(engl.: DNA; deutsch: DNS) ist ein langes spiralförmiges Kettenmolekül,
das als Träger der Erbinformation dient undaus vielen Bausteinen,
die man Desoxyribonukleotide oder kurz Nukleotide nennt. Jedes Nukleotid
hat drei Bestandteile: Phosphorsäure bzw. Phosphat, den Zucker Desoxyribose
sowie eine heterozyklische Nukleobase oder kurz Base. Die Desoxyribose-
und Phosphorsäure-Untereinheiten sind bei jedem Nukleotid gleich.
Sie bilden das Rückgrat des Moleküls. Einheiten aus Base und Zucker
(ohne Phosphat) werden als Nukleoside bezeichnet. Die Phosphatreste
sind aufgrund ihrer negativen Ladung hydrophil, sie geben DNA in
wässriger Lösung insgesamt eine negative Ladung. Da diese negativ
geladene, in Wasser gelöste DNA keine weiteren Protonen abgeben
kann, handelt es sich streng genommen nicht (mehr) um eine Säure.
Der Begriff Desoxyribonukleinsäure bezieht sich auf einen ungeladenen
Zustand, in dem Protonen an die Phosphatreste angelagert sind. Bei
der Base kann es sich um ein Purin, nämlich Adenin (A) oder Guanin
(G), oder um ein Pyrimidin, nämlich Thymin (T) oder Cytosin (C),
handeln. Da sich die vier verschiedenen Nukleotide nur durch ihre
Base unterscheiden, werden die Abkürzungen A, G, T und C auch für
die entsprechenden Nukleotide verwendet. Anhand dieser Erbinformationen,
die in einer bestimmten Form, dem genetischen Code, in der DNS gespeichert
sind, werden Proteine produziert. Für ihre Entdeckungen über die
Molekularstruktur der Nukleinsäuren und ihre Bedeutung für die Informationsübertragung
in lebender Substanz“ erhielten Watson und Crick zusammen mit Maurice
Wilkins 1962 den Nobelpreis für Medizin. DNA kommt normalerweise
als schraubenförmige Doppelhelix vor, wobei zwei in entgegengesetzter
Richtung als Einzelstränge aneinandergelagert sind. Durch die Aneinanderlagerung
stehen sich in der Mitte der Doppelhelix stets zwei Basenpaare gegenüber.
Die DNS liegt in einer dreidimensionalen Hilbertkurve
im Zellkern vor:

(www.wired.com/wiredscience/2009/10/fractal-genome/)
Dahlke, Rüdiger Dr. Dahlke vertritt im senkrechten Weltbild die Ansicht, es könne auf jeder Ebene angesetzt werden, um Heilung herbeizuführen. Eine Organschädigung sei die Spitze des Eisbergs und ursprünglich oft auf eine Störung des Energiehaushaltes zurückzuführen. Zu jeder Zeit benötige der menschliche Organismus Phasen der Aufladung und Regeneration. Wasser könne dabei ein Schlüssel zur Erholung und Stärkung gesundheitlicher Kräfte sein.
|




